
010-6275-5647
牛顿曾经说过:“如果说我看得比别人更远些,那是因为我站在巨人的肩膀上。” 10月17日-18日尹放东博士就在IPEM的课堂上,带领学员们站在比制药业更高的维度来看待问题,其思考问题的方式、层面还原了制造科学在制药行业应该的样子。透过科学定义和基本概念,活用评估、量化、比较,启发学员从关注“是什么”和“怎么做”,到关注“为什么”,不仅合规,更须合理。
下文整理了部分课程精华,作为课程的延续和深入,10月31日-11月1日,尹博士将在IPEM上海课程中详解“生命周期的工艺验证”(点击查看详情),课程将从工艺和验证的关键定义和基本概念入手,阐明相关理论和体系,尤其关注评估、量化、比较和应用;以科学方法、工程原理、统计分析、风险管理为手段,对工艺验证进行系统、全面的介绍;以尊重逻辑、重视理念、关注应用、解决工艺验证中的实际和复杂问题为目的,运用具体案例,解说基本概念、普遍原理在研发、放大、验证中的实际应用。
什么是“制造科学”?
目前在制造行业,没有一门独立学科专门研究和涉及制造科学。尹博正在尝试开发“制造科学”作为一门全新、跨学科的应用科学,应用科学和工程的原理,研究产品/工艺、设备/设施、客户/市场、法规/合规等,以及它们之间基本和普遍的关系。制药行业在所有制造业中属于垫底水平,总是为了满足法规要求而做,很少把实践做成知识和科学。
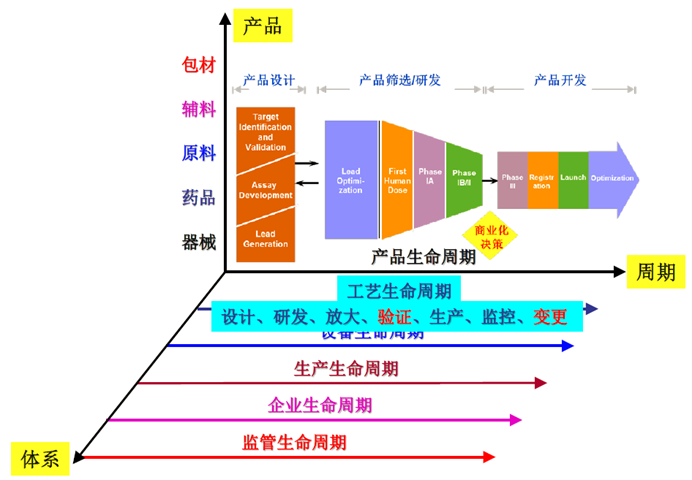
制造科学框架和模块
药品质量的含义
通过8月9日识林资讯【质量对话】糊里糊涂地谈质量?,可以延伸探讨“药品质量”和“药品性能”的区别:
质量是一个有趣而困惑的概念,每人都有一些想法,不少人却有不同的理解;常常难以解释、沟通、达成共识 – “看得见、摸得着、说不清”?从根本上而言、从制造科学而言,制药行业和所有制造行业之间应该有相同的质量定义和理念。对于厂商来讲,“药品质量”主要包括剂量、组分、含量、纯度、杂质等质量属性;“药品性能”主要为安全性、有效性、功能性等性能特性。而对于患者而言,药品质量包括安全性、疗效等的一切。质量的定义取决于从谁的角度来看待问题。所以就有了性能与质量的关系:性能(安全/疗效)=f(质量,医生,患者)。建立质量与性能的正确关系,就使得通过性能与质量实现性能成为可能,而质量的实现就要建立质量标准和质量水平,质量标准又是通过建立产品与工艺、设备、设施的关系及控制策略等来实现的。
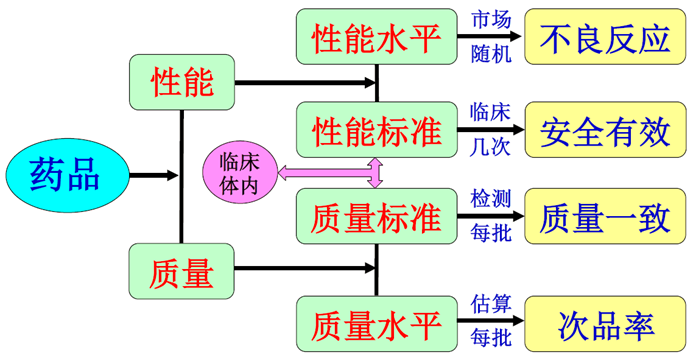
药品:性能与质量
质量标准的建立
课程中的4个案例,从临床溶出、杂质、冻干产品和可见颗粒建立质量标准的考虑点,引出了对质量标准的深入思考:质量标准的建立一定要有相关联、有意义的数据(知识)支持。制药行业存在着本末倒置的扭曲:监管部门和业界总是追逐标准越严越好,导致耗时烧钱少回报。应追求”最严谨的标准”,而不是”最严标准”。在制药业产品质量标准的确立常常没有科学依据,这是造成产品质量问题的关键根源之一。
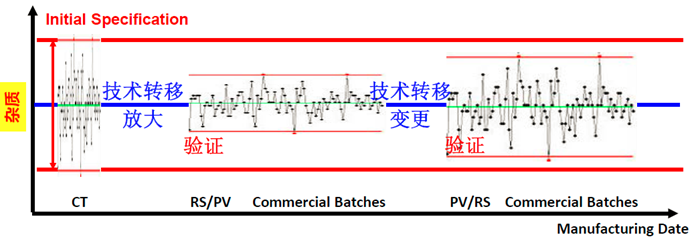
案例分析:杂质含量
尹博士的两位同事为大家分享了化学反应动力学在药物稳定性研究中的应用。仲小燕老师主要讲述化学反应动力学中Arrhenius公式的应用,并举案例讲解如何运用公式计算产品浓度随时间和温度的变化(稳定性研究)。徐丹老师讲述如何进行稳定性预算分配,即如何运用公式计算,在包装、贴签、储存和运输中,基于产品的研究,对偏离储存温度的时间进行合理分配,而不产生显著的质量风险。
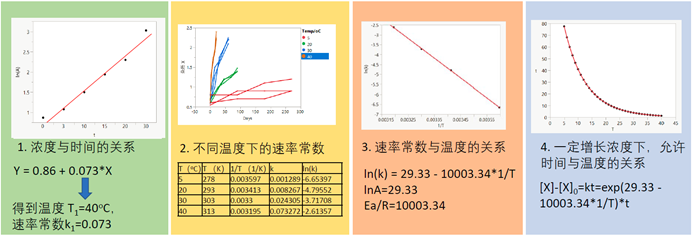
公式应用 - 实例分析
产品质量的一致性评价
产品质量的一致性评价离不开对工艺的研究和知识,应从研发的角度(技术层面)来评估变更,而不仅是基于法规分类。变更的目的是互换替代,标准是性能一致;变更 ≠ 变化;变更 = 变化、更换。因此,质量一致不代表质量属性数值一致、不变,而是质量合格层次的一致(可互换替代),这也是变更的目的和核心。在对比技术转移的地产原研药和仿制药时强调,由于原研公司的质量标准体系,仿制公司看不见、得不到、比不了。因此,原研药和仿制药只能药典质量标准一致(仿制公司看得见),并非整个质量体系(放行、效期、中控、耗材、原料、辅料、包材)一致(仿制公司看不见)。原研药和仿制药只能性能的一致,不是质量的完全一致;而性能(疗效)一致必须通过药学等效+生物等效达到。另外,更重要的是地产原研药的技术转移可以得到转移送方的完全支持,对所有影响质量的因素直接进行比较和控制(原/辅料、包材、中控﹑厂房、设备、方法转移/验证、工艺转移/验证等等),以保证受方的产品质量可以从根本上与送方的产品质量保持一致。
工艺与控制
工艺的核心理念,是运用科学和工程的原理,研究产品/工艺、设备,刻画建立质量属性与工艺参数的关系。工艺变异性的根源在于对控制策略的有限理解和控制能力的有限控制。强调控制策略的定义、PQLI控制策略模型、产品与工艺的关系如何通过控制策略和工艺模型实现,并指出知识管理在控制策略生命周期中的作用。通过案例分析和板书工艺能力指数的计算方式,指出行业片面强调狭义的设计(设计空间和实验设计),而忽略了产品、工艺和设备的更重要的设计,及控制和检测的重要性。
课程通过多种案例解析工艺设计和工艺研发的方法,点明工艺设计的要求、合格工艺的标准,并强调质量属性和工艺参数的关联性,以及识别潜在关键质量属性和关键工艺参数的方法。
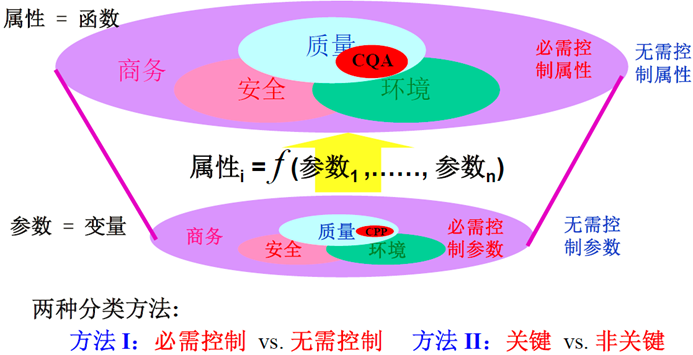
质量属性与工艺参数的关系
工艺放大的成功,取决于充分认识和理解工艺和设备不同规模的差异,并建立工艺和设备不同规模之间的关联关系(如工艺放大参数)。并以冻干工艺放大为例,解析工艺放大的核心和思路,及工艺放大参数和模型的建立。
关于工艺的最后一部分讲工艺变更,包括工艺变更的核心理念、工艺变更的核心和关键。通过解析辅料变更、工艺放大变更、产地变更、技术转移变更4个变更案例,强调评价方法和标准不仅取决于变化及大小,更取决于对变化的了解;工艺的研究与知识,不仅有助于使用正确的评价方法和标准,并且能更好地控制工艺变更。
连续制造
课程最后一部分,讲连续制造的理念与实施,包括连续制造工艺的定义、连续制造技术平台的演示、为什么实施连续制造、行业和监管对于连续制造关注的热点、连续制造与批式制造的对比和核心理念、连续制造的研发/放大/商品化流程,并基于案例解析连续制造模型以及连续制造的核心与优势。
课程预告: