
010-6275-5647
“我们研究所只负责体外研究,保证体外四条曲线一致,BE试验由企业自行开展。”
“我们开发的是有体内预测力的溶出方法,保你BE试验顺利通过,通不过全额退款。”
“第一次预BE通不过,费用企业承担,二次预BE通不过,双方各承担50%,三次…….”
“基地现在试验床位很紧张,要争取一次通过BE试验,四条溶出曲线一定要一致。”
溶出方法经历了从“标准的”到“有区分力的”再到“有体内预测力的”认识上的提高,作为一名曾经的药企研发高管,当面对上千万元的BE试验投入、研发机构的信誓旦旦、“有限责任”以及临床基地“有限承担责任”的能力时,暂且不论预BE通过或不通过的说法是否科学,“有体内预测力”的溶出方法(IPD)就是能看得见的“最后一根稻草”。但前提是:企业作为申办者,对有体内预测力的溶出方法应有基本的科学认知。
时光回转,自从1977年美国颁布生物利用度/生物等效性法规后,制药科学技术迅猛发展,为证明BE的监管方法提供了机会。90年代,GORDON L. AMIDON 博士,美国密歇根大学药学院制药科学教授,美国药学会前主席,创建了生物药剂学分类系统(BCS),并与FDA一起推动了影响了全球的生物等效标准。2000 年和 2015 年,FDA 分别发布及修改了基于BCS分类系统的速释(IR)固体口服制剂 BCS 分类 I 和 III 类体内生物利用度和 BE 研究豁免的指南,毫不夸张的说,BCS 分类系统的建立带来了 BE 史上划时代的转折。然而,BCS II 类和 IV 类药物在体内、外的溶出度却高度依赖药物的酸、碱性、药物溶解性、配方因素,以及在胃肠道复杂多变的体内环境:包括变化的 pH、缓冲能力、腔体体积、表面活性剂、腔内条件、沿胃肠道的渗透性分布,以及可变的中转、空腹和进食状态。体外溶出方法选择的复杂性让业界头痛不已。

GORDON L. AMIDON 博士
2014年,GORDON L. AMIDON 博士对原始 BCS 分类的 II 类和 IV 类扩展为生理 pH 范围(~pH < 7.5)的酸性(a)、碱性(b)或中性(c),提出了 BCS 亚分类理论,并将之用于有体内预测力的溶出方法(IPD)的开发和诠释体内外相关性(IVIVC)。
BCS IIa 类药物,通常是 pKa 范围为 4 到 5 的羧酸,在典型空腹胃部 pH 下不溶,但在肠道 pH 下可溶,因此根据在 pH=6.5 的空肠渗透性或在人体中的剂量吸收率测定分类为 BCS II 类或 IV 类。当肠道 pH 为 ~6.5 时,酸性药物 (pKa ~ 4–5)的溶解性和可能的溶出速率将在进入小肠时增加至约100倍或更多。因此,溶出可能显著快于平均胃排空速率(半衰期约为 15 分钟),这取决于剂量和固有溶解度。因此,如同具有快速溶解性的 BCS I 类药品一样,BCS IIa 药物的血浆水平可能反应了胃排空和腔内 pH 差异,而不是产品差异。基于此,WHO 和欧洲药品管理局的 BE 标准中,某些 BCS II 类药物(例如,BCS IIa 类)已被推荐为是生物豁免的候选药物。
以下示例药物将进一步说明 BCS 亚分类的用途:IIa 类布洛芬、氟比洛芬、萘普生和酮洛芬(弱酸性),IIb 类卡维地洛和酮康唑(弱碱性)以及 IIc 类非诺贝特和达那唑(中性)。
BCS IIa 弱酸,尤其是小分子非甾体抗炎药物(NSAID),在酸性胃部 pH 下显示低溶解度,但在小肠中溶出迅速并表现得像 BCS I 类药物;BCS IIb 弱碱在胃部酸性 pH 下显示出高溶解度,但在小肠中沉淀,而其药物的肠道沉淀取决于药物处方和胃肠道生理因素 (腔内成分)和环境。因此,赋形剂可改变沉淀及溶液浓度,BCS II 类弱酸性和碱性由于胃肠道 pH的变化而表现出互补的溶解度曲线。 BCS IIc 类药物的溶解度则不会受到这种体内 pH 变化的影响,但体内环境,例如表面活性剂和脂质,在 BCS IIc 类药物溶出中发挥着显著但难以预测的作用。体内过程变化具有时间依赖性和复杂性,这种溶解介质可能并不能完全代表其体内特性。综上,BCS II 类药物具有各自不同的生物药性质,对配方、胃肠溶解度、溶出速率以及由此产生的体内空腹吸收和生物利用度曲线具有巨大影响。因此,基于这些生物药特性的 BCS 亚分类将有助于设定有预测力的溶出方法,可以称之为“关键溶出标准”,将为体内表现(即,体内 BE)提供最佳保障。
“关键溶出标准”同时还是创新药不同临床试验阶段安全性和有效性桥接的工具,并可实现药物在产品生命周期内对体内溶出的匹配,因此是口服固体制剂产品最重要和最基本的药物质量标准。而 BCS 亚分类和 IPD 方法为开发这一药物质量标准提供了一个起点。
4月10-11日,BCS 分类的创始人,GORDON L. AMIDON 博士同现任 FDA 药品质量办公室副主任的余煊强博士、FDA 仿制药办公室 BE 一处代理处长李冰博士和其他 FDA 审评专家和学者将在北京大学药物信息与工程研究中心主办的“中美药监生物等效性会议”上,与我国食药总局 CDE 审评专家同堂探讨,并分享“有预测力溶出方法和体内外相关性(IVIVIC)”的最新研究进展。这将是 BE 领域一次国际高水平的科学聚会,让众多业界人士翘首以待。
会议信息
时间地点:2017年4月10-11日 北京友谊宾馆
日程详见:【研讨会】中美药监生物等效性会议第二轮通知 (点击标题查看)
收费标准:
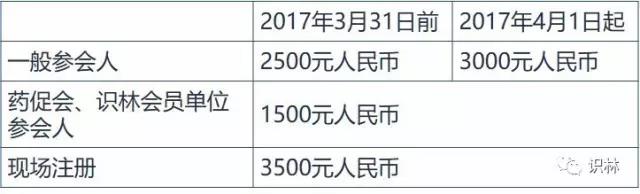
注册费含会议资料、茶歇和午餐
注册报名
即日起登录网站( http://www.cpier.pku.edu.cn )在线报名、点击文末阅读原文或长按识别下方二维码在线报名。

电话:010-62750825 / 62750823
邮箱:BE@cpier.pku.edu.cn